DCB產資組ITIS研究團隊
莊昭儀
2024年1月
藥物傳遞系統(Drug Delivery System, DDS)夠改變藥品的基本特性,包含其物理化學和生物特性,還可能使藥物動力學(Pharmacokinetics, PK)和生物活性分布(biodistribution)曲線完全不同。DDS具有三個重要功能:可以和藥品結合並能調整藥品負載量、在到達目標之前保持藥品與整體遞送系統的穩定性,以及透過時間與空間皆可監控的過程來釋放藥品。目前主要開發的DDS材料包含:脂質(lipids)、無機奈米顆粒(inorganic nanoparticles)、工程微粒(engineered microparticles)、水膠(hydrogels)、生物性大分子(biomacromolecules)、聚合物(polymers)和活性/滅活性微生物(live/deactivated microorganisms)。
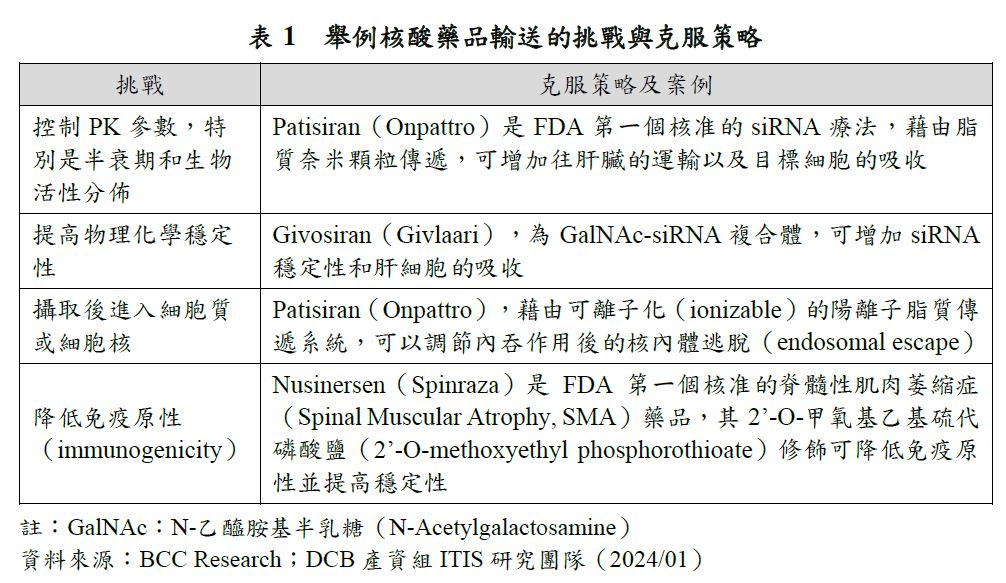
由於RNA的療法需要將治療性RNA送至目標細胞內才能發揮作用,然而核酸的親水性、負電荷,及分子大小可能使其無法被動穿過細胞膜,因此,如何克服細胞內外屏障並且安全有效率的將RNA遞送到細胞內,是RNA治療是否成功的重要關鍵。過去核酸藥品的傳遞面臨了一些挑戰如:裸露的單鏈RNA可能會被酶降解,及可能活化免疫系統造成免疫脫靶效應(immunological off-target effects)等,均可能導致藥效不如預期,或嚴重副作用。為了克服上述RNA藥品傳遞的相關挑戰,體內RNA傳遞技術陸續出現新突破,如:脂質奈米顆粒(Lipid Nanoparticles, LNP)、共軛物(conjugates)、各類RNA序列修飾的使用。配合RNA藥品之治療特性、標靶細胞類型和所需的遞送途徑,如siRNA和mRNA多需要送至細胞質中才能發揮療效,而反義寡核苷酸(Antisense Oligonucleotide, ASO)和常間回文重複序列叢集(Clustered Regularly Interspaced Short Palindromic Repeat, CRISPR)則須送至細胞核中才可作用,選擇合適之DDS可以將核酸以更安全、有效的方法運送到細胞中,進而實現此類藥物的商業化落地,大大的提升了RNA產品的治療效率與成藥的可能性(表1)。
一、RNA藥品的給藥方式
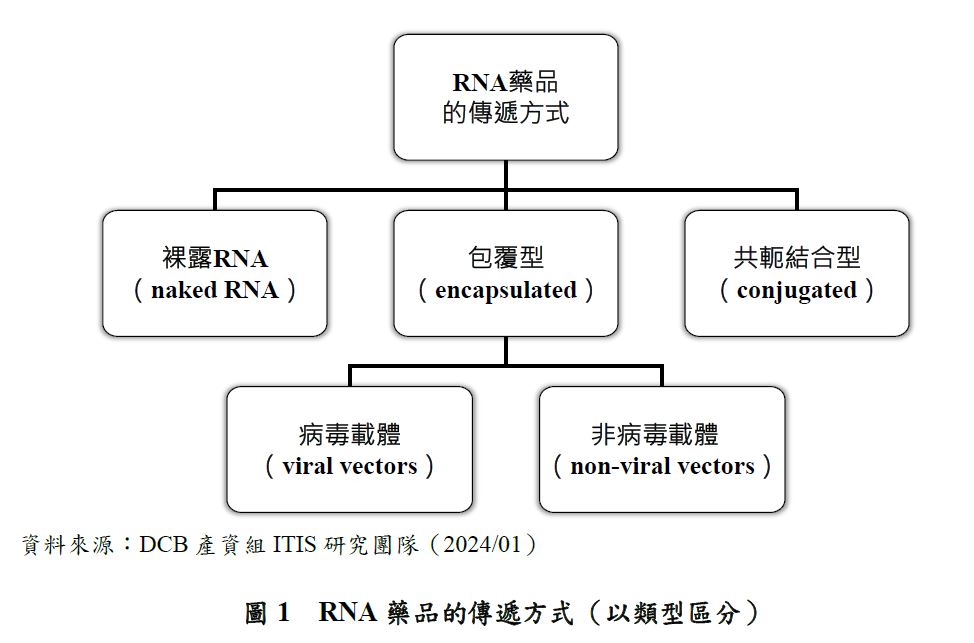
RNA藥品的給藥方式可以分成3大類,包含:包覆型(encapsulated)、共軛結合型(conjugated),和直接以裸露RNA(naked RNA)給藥的方法;其中,包覆型又可以分為以病毒載體(viral vectors)包覆和以非病毒載體(non-viral vectors)包覆2種(圖1)。
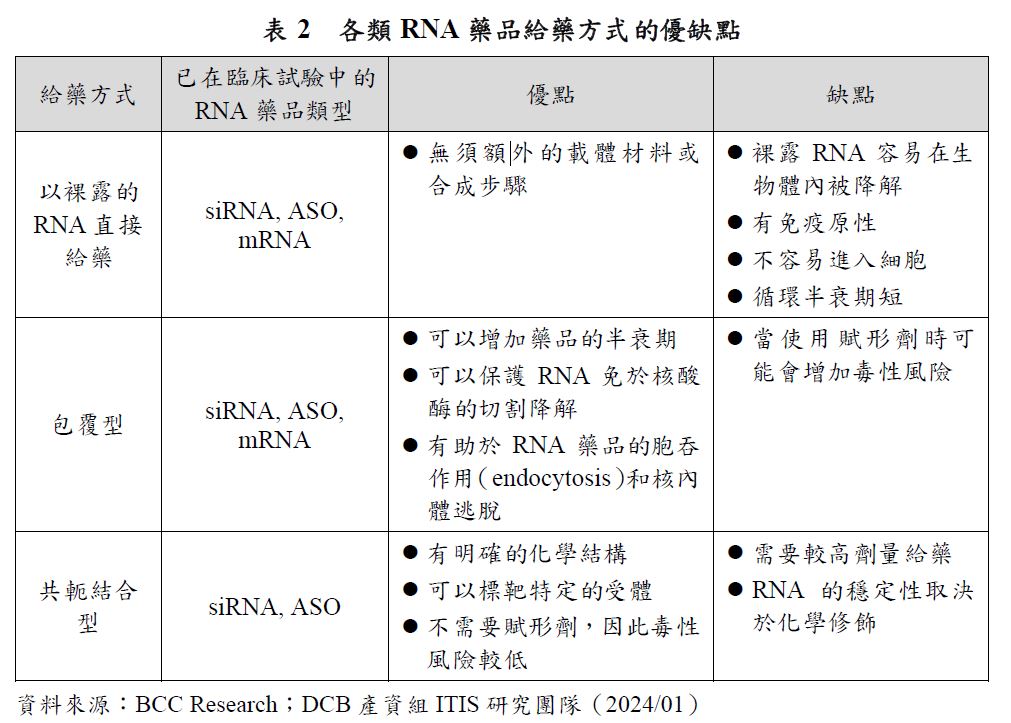
以裸露RNA直接給藥比較不適合用於siRNA、miRNA和mRNA,但可用於ASO。包覆型的傳遞方式可適用於ASO、mRNA和siRNA藥品,而共軛結合型的傳遞方式已知用於已上市之siRNA藥品。每種RNA藥品的給藥方法都有其優點和缺點,相關說明如表2。
二、RNA藥品蓬勃發展驅動相關DDS市場增長
近年來,核酸藥品的核准不斷增加。以RNAi藥品為例,patisiran是2018年第一個獲得核准的藥品,第二個藥品givosiran於2019年獲得核准,lumasiran於2020年11月獲得核准,另外還有7個RNAi藥品:vutrisiran、nedosiran、inclisiran、fitusiran、teprasiran、cosdosiran和tivanisiran已進入臨床3期試驗階段,預計2025年也將獲得核准。根據BCC Research資料,開發中的RNA藥品,從2017年381件增加到2022年5月的852件,而臨床試驗也從2020年的104個試驗增加到2021年的197個。核酸藥品的蓬勃發展帶動了對於RNA DDS的需求,也推動了RNA DDS的市場。
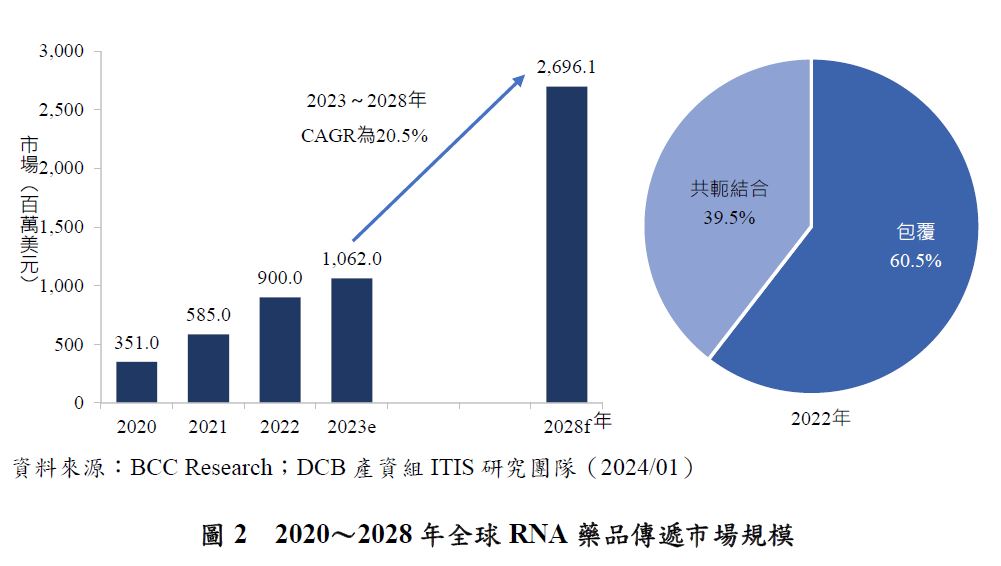
RNA藥品的DDS可以分為兩種類型:利用載體傳遞的包覆型(encapsulated)和非利用載體傳遞的共軛結合型(conjugated)。根據BCC Research資料,2022年全球核酸藥品傳遞市場規模為9.0億美元(圖2),受核准上市的RNA藥品增加、新型RNA藥品輸送系統的出現與開發、核酸藥品市場的增長影響,預估2023~2028年核酸藥品傳遞市場將以20.5%的2位數年複合年成長率(Compound Annual Growth Rate, CAGR)增長,預計到2028年底市場規模將達到27.0億美元。2022年市場主要由價格較為昂貴之包覆型的傳遞系統占據,約占60.5%,此外該領域正在進行大量研究,如mRNA的疫苗即以使用包覆型的傳遞系統為主,是其市場占比較高的原因之一。
一些新型的輸送系統出現也將促進RNA DDS市場成長,如:外泌體、球形核酸(Spherical Nucleic Acids, SNA)和DNA奈米結構(DNA nanostructures)。外泌體是脂質膜包裹的囊泡,存在於所有體液中,並由大多數細胞分泌,是重要的細胞間通訊介質。外泌體可以運輸生物活性成分並克服生物屏障(如血腦屏障),且免疫清除率和不良影響小,所以修飾過的外泌體可用於傳遞不同種類的RNA。SNA是一群核酸與無機奈米顆粒核心共價鍵結所形成的球型結構,由於可以快速的被細胞攝取,並且引起的免疫反應可以忽略不計,所以能夠有效地傳遞核酸。DNA奈米結構是由DNA透過本身序列互補或共價結合的特性,組裝折疊成使用者定義的形狀,並可以透過在結構表面摻入ASO或siRNA來傳遞核酸藥品。
三、包覆型RNA藥品DDS中的病毒載體以腺相關病毒為主流
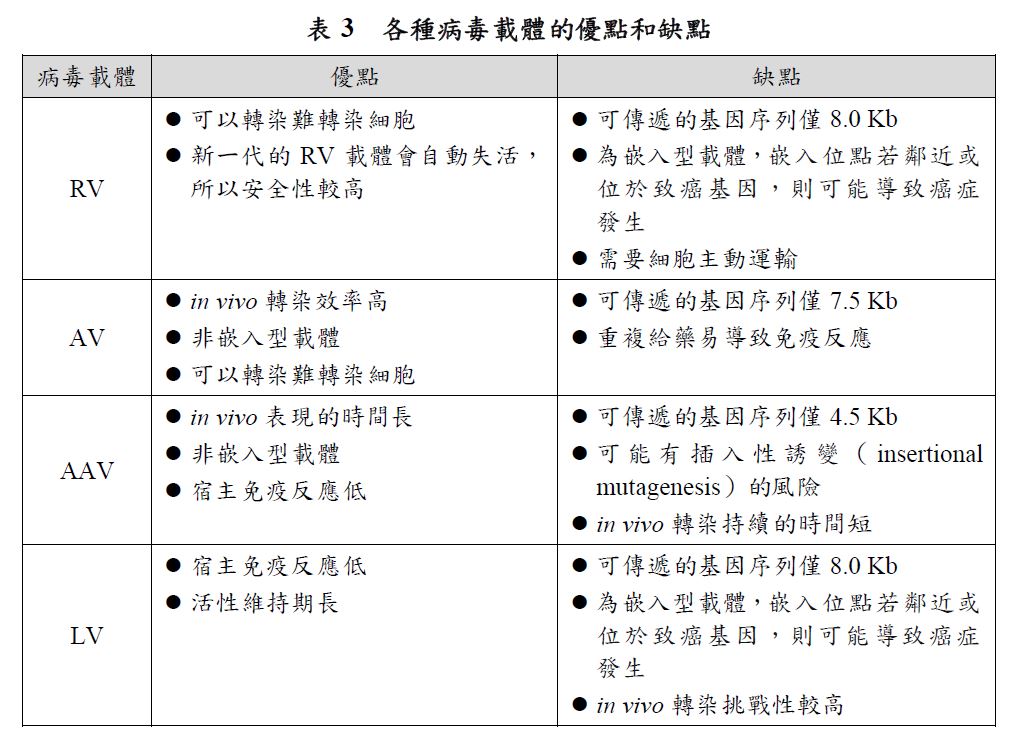
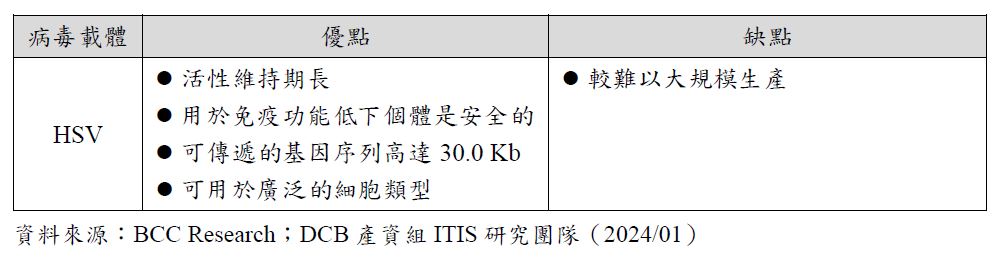
包覆型RNA藥品DDS中,病毒載體可以輕鬆的進入細胞、標靶困難靶點或度特異性的目標細胞,是傳遞RNA藥品有用而且強大的工具。但是病毒載體也存在著許多缺點,如:可能引起免疫反應、病毒誘導的免疫原性、可能將外來序列嵌入非目標基因、負載大小限制、無法再給藥(re-dose)、放大過程中涉及複雜及昂貴的載體生產。根據BCC Research資料,目前應用於基因治療的病毒載體已有5種:反轉錄病毒(Retroviruses, RV)、腺病毒(Adenoviruses, AV)、腺相關病毒(Adeno-Associated Viruses, AAV)、慢病毒(Lentiviruses, LV)和單純皰疹病毒(Herpes Simplex Viruses, HSV),各種病毒載體的優缺點分析於表3。其中,RV、AV、AAV和LV,因其可裝載傳遞的基因序列僅8.0Kb以下,若裝載更大的序列時可能導致病毒產量明顯下將。AAV因其具備安全性、低致病性、結構及製程簡單,以及高效且穩定的傳遞方式,所以成為基因療法中最受歡迎的病毒載體傳遞形式。根據BCC Research資料,2020年,基於病毒載體的基因治療領域的投資高達4.5億美元。
四、包覆型RNA藥品DDS中的非病毒載體以脂質為主流
包覆型RNA藥品DDS的非病毒系統,可依其材料分為3種主要類型:脂質(lipid-based)、聚合物(polymer based)和其他(如:無機材料、混合的材料)。
脂質與LNP是常見的DDS,如:FDA核准用於肝臟siRNA遞送(藥品patisiran的LNP)和mRNA疫苗(BNT162b2/ Pfizer-BioNTech和mRNA-1273/ Moderna COVID-19疫苗的LNP)遞送的LNP。FDA核准的LNP結構包含4種基本組成成分:膽固醇(cholesterol)、輔助脂質(helper lipid)如二硬脂酸基磷脂醯膽鹼(Distearoylphosphatidylcholine, DSPC)、PEG-脂質(poly (ethylene glycol) (PEG) -lipid),和陽離子(cationic)/可解離脂質(ionizable lipid)。上述4種成分可依不同比例組成LNP,例如圖3的Pfizer-BioNTech之COVID-19疫苗和Alnylam之patisiran,進而影響載體的穩定性或是進入細胞的效率。
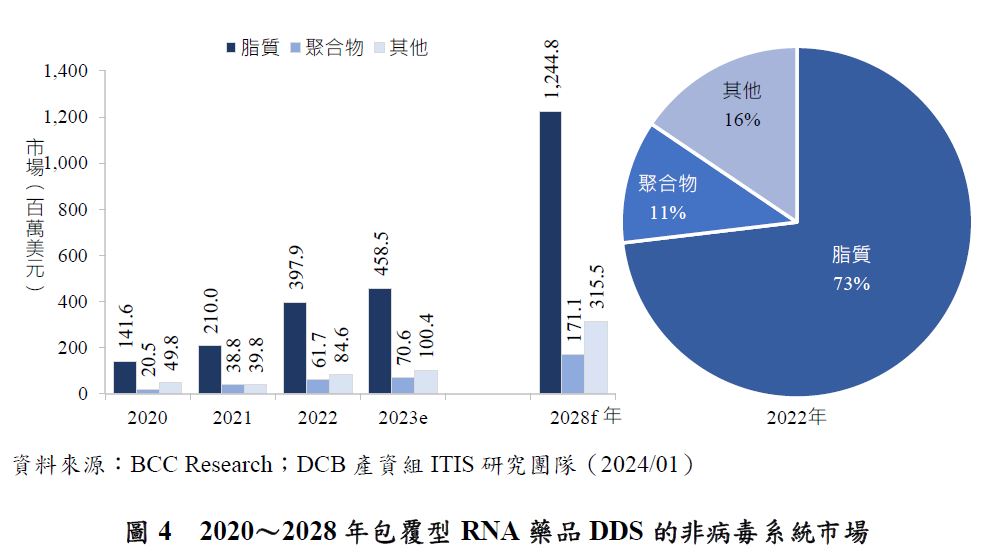
脂質占包覆型RNA藥品DDS的非病毒系統市場比例最大,2022年占比73.1%,約為4.0億美元。由於COVID-19後mRNA藥品發展蓬勃,並且mRNA藥品多以脂質為載體材料,預估脂質材料的市場將以21.7%的CAGR快速增長,到2028年底將達到12.2億美元(圖4)。
五、共軛結合型DDS因其結構簡單易製造使市場快速增長
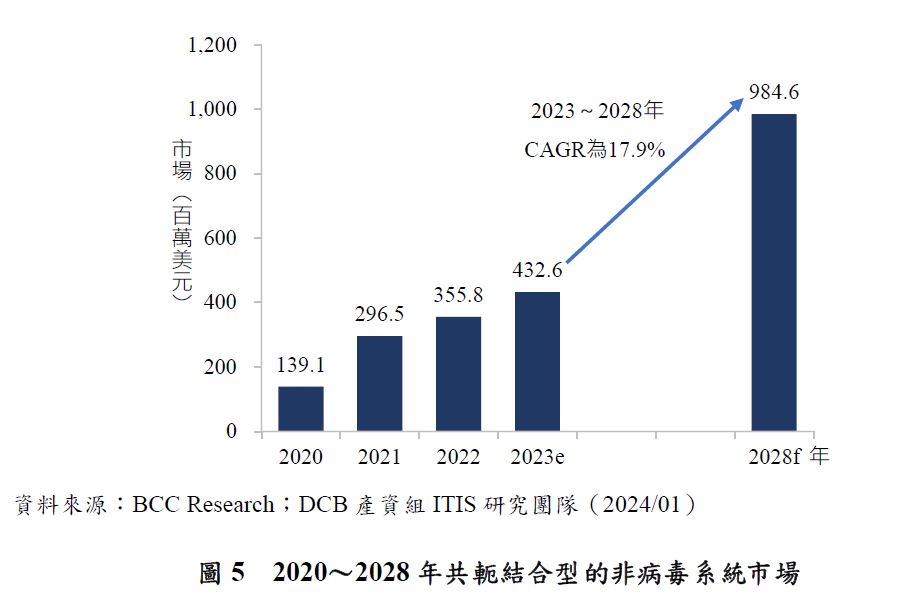
共軛結合型DDS的開發歷史始於1968年時,以發現去唾液酸糖蛋白受體(Asialoglycoprotein Receptors, ASGPR,又名hepatic binding protein或Ashwell–Morell receptor)為開端。GalNAc可與位於肝細胞竇(sinusoidal surface of the hepatocyte)表面的ASGPR結合。RNA治療公司Alnylam Pharmaceuticals首先開發出將修飾過後的siRNA分子與GalNAc中糖的結構部分結合,形成GalNAc-siRNA複合體,再藉由GalNAc與ASGPR結合特性以標靶肝細胞。由於siRNA-GalNAc複合體相較於LNP製劑,是一種結構簡單、分子更小且成分明確的肝臟遞送方法,近年來也吸引不少藥廠投入開發,如:Alnylam Pharmaceuticals、Arrowhead Pharmaceuticals和Dicerna Pharmaceuticals,市場快速成長,根據BCC Research資料,2022年全球共軛結合型DDS市場規模為3.6億美元,預估在2023~2028年將以17.9%的CAGR增長,預計到2028年底將達到9.8億美元(圖5)。
六、結語
過去10年,由臨床前和臨床數據可看出核酸療法治療疾病的潛力,因應COVID-19疫情而快速發展上市mRNA疫苗更是推動了該領域的進展。DDS的發展使核酸藥品在細胞中特定的位置發揮功效,推進了核酸療法的成功。
觀察目前FDA核准或獲EUA的3種RNA DDS,可以歸納出6個共同特點,滿足這些特點可能成為核准遞送載體的標準。這6個特點包括:(1)使用可生物降解、可量產的化學物質合成DDS、(2)DDS的化學結構需簡單,能大量生產以滿足臨床需求、(3)DDS必須具備可接受的標靶與脫靶遞送比率、(4)DDS攜帶RNA遞送系統攜帶RNA達到療效所需劑量應遠低於產生毒性的劑量、(5)藥品活性應在多批次間保持一致,即使在運輸之後也是如此、(6)在多數臨床情境下,為保持生物效應或劑量效應,需要重複給予RNA藥品,因此DDS應滿足重複給藥的需求。廠商在相關RNA藥品治療開發時可參考上述特點,提高RNA DDS開發的成功率。
臺灣核酸藥品多在早期開發階段,但已有不同廠商分別投入不同之關鍵技術,如:核酸藥品新藥開發、核酸DDS開發、核酸藥品量產代工製造。臺灣廠商如可以持續精進已投入的方向,透過專業分工,啟動產業合作,整合各自專業以加速臺灣核酸藥品發展,將有助於我國提高生技醫藥產業之國際競爭力。