生物技術開發中心
寇怡衡
2025年2月
2017年美國FDA核准第1個病毒載體基因治療、首2項CAR-T療法;2023~2024年核准第1個基因編輯療法及第1個TCR-T細胞療法,讓基因治療的發展達成重要里程碑,目前全球已核准32項基因治療上市。本報告整理基因治療發展現況,並介紹類似作用機制的療法(CAR-T療法及TCR-T療法),以及相同應用但不同機制的療法(Casgevy及Lyfgenia基因編輯HSC),最後說明基因治療的挑戰。
一、基因治療定義及產品範疇
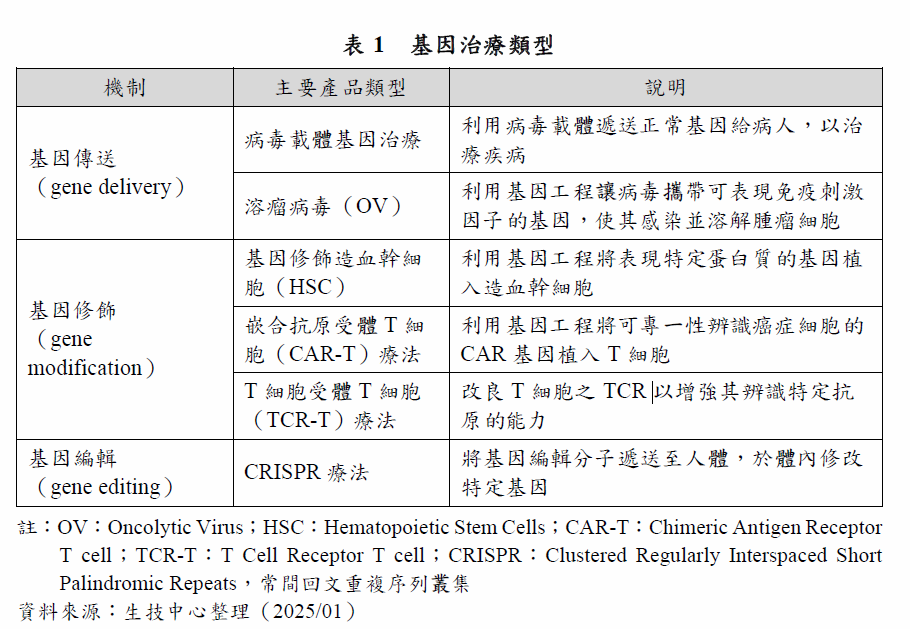
基因治療態型多元,各國對於基因治療的定義及範疇亦略有差異,全球主要醫藥市場對於基因治療的定義可參考醫藥產業年鑑的整理1。綜合來說,基因治療是指修改人類基因以治療疾病的技術,本報告所涵蓋之各類型產品定義說明如表1。
基因治療依基因修飾或基因編輯是否發生在人體內,大致可分為體內(in vivo)和離體(ex vivo)基因治療。In vivo是將治療疾病的基因直接遞送至病人體內,基因本身即是治療藥物,例如病毒載體基因治療;ex vivo則是將病人的細胞先在體外進行基因修改後再輸送回體內,是透過基因修飾而產生治療藥物,例如CAR-T療法。
基因治療可以透過不同的遞送方式,例如病毒載體、非病毒載體、物理性遞送(如電穿孔(electroporation))等。病毒載體因為具有較佳的基因遞送能力,被廣泛用於基因治療,約占90%。其中腺相關病毒(Adeno-Associated Virus, AAV)因為嵌入病人基因體的機率低,且具有低免疫源性,被普遍使用於in vivo的病毒載體基因治療,約占49%。其次為慢病毒(lentivirus, LV)載體,約占23%,因為LV易於基因體融合(integration)的特性,有利於ex vivo進行細胞的基因修飾,所以CAR-T療法多使用LV載體,透過病毒載體將CAR基因送到T細胞,約占產品數量的65%,其次為反轉錄病毒載體,兩者合計占CAR-T療法產品數量的8成。
二、基因治療發展現況
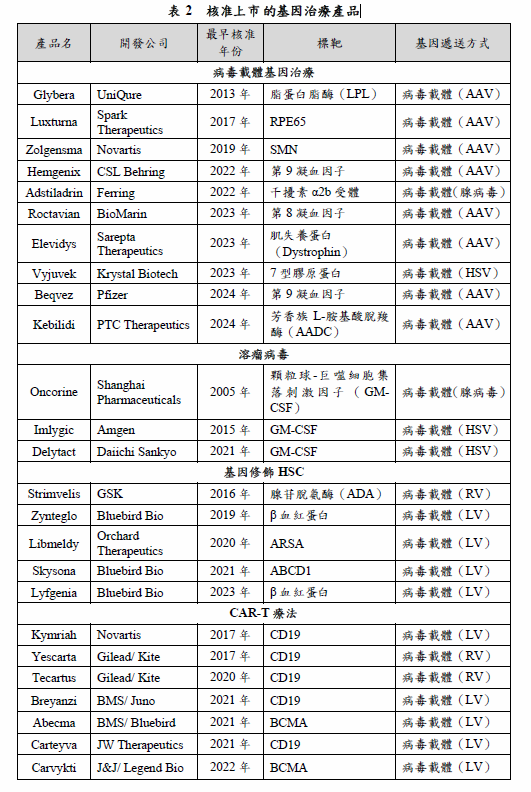
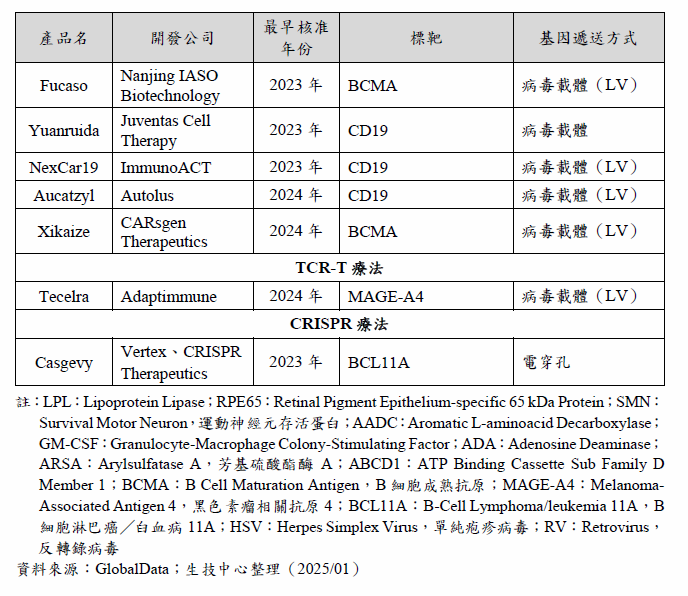
2017年是基因治療發展一個重要的里程碑,美國FDA核准了第1個AAV載體基因治療Luxturna,以及首2個CAR-T療法Kymriah、Yescarta;2023年及2024年,美國FDA又相繼核准了第1個基因編輯療法Casgevy及第1個TCR-T療法Tecelra,基因治療的發展再向前邁進一步。隨著基因工程、基因編輯等技術越來越成熟,基因治療型態也更加多元,至2024年12月,全球共核准32項基因治療(表2),包括病毒載體基因治療10項、溶瘤病毒3項、基因修飾造血幹細胞5項、CAR-T療法12項、TCR-T療法1項及CRISPR療法1項。根據Citeline公司的統計,目前開發中的基因治療產品超過2,000項,其中超過半數為基因修飾細胞療法(包括基因修飾造血幹細胞(HSC)、CAR-T療法、TCR-T療法等),約占基因治療產品數的55%;其次為基因傳送型態的基因治療,約占35%;基因編輯療法數量則較少,只占約10%。
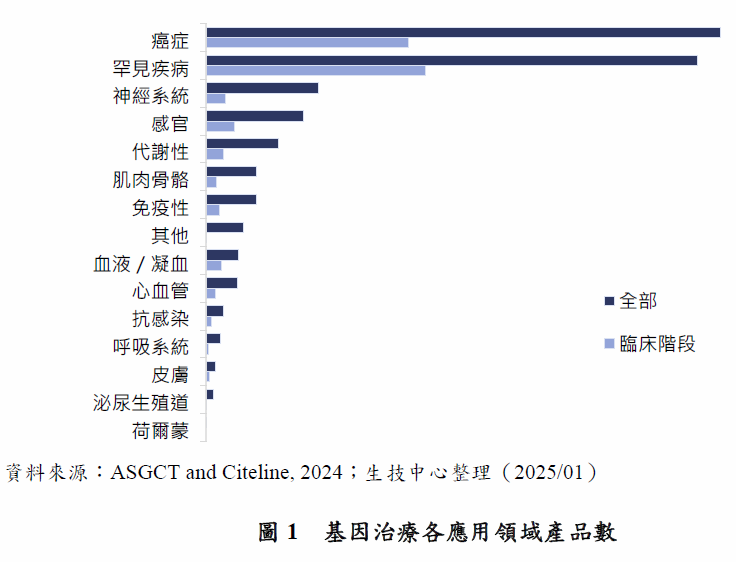
各類型基因治療因作用機制不同,各有其應用優勢。病毒載體基因治療可傳送正常基因至體內,適合應用於基因缺陷造成的遺傳性疾病;例如Elevidys利用AAV載體遞送的肌失養蛋白正常基因至病人體內,用於治療裘馨氏肌肉失養症(Duchenne Muscular Dystrophy, DMD)。基因編輯療法可直接將異常的基因序列替換為正常的序列,適合用於基因突變造成的遺傳性疾病;例如CRISPR療法Casgevy直接編輯BCL11A基因的序列,恢復胎兒血紅蛋白的生產,用以治療鐮刀型紅血球疾病(Sickle Cell Disease, SCD)。而CAR-T療法或TCR-T療法,主要是加強T細胞辨識及毒殺腫瘤細胞的能力,適應症以癌症為主;例如全球首例CAR-T療法Kymriah,便是利用LV載體遞送CD19受體的基因至T細胞,在T細胞表面表現CD19受體,讓病人自己的T細胞可以辨識過度表達CD19的B細胞癌。進一步分析基因治療的應用領域(圖1),根據Citeline於2024年10月發表的報告2,開發中基因治療應用於癌症和罕見疾病的數量,分別占所有基因治療數量的33.4%和31.9%。若只分析臨床試驗階段的產品,則應用於罕見疾病的略多於癌症,占比分別為36.9%(癌症)和40%(罕見疾病)。而基因治療於罕見疾病的適應症中,有53%為癌症,數量前5名依序為骨髓瘤、急性骨髓性白血病(Acute Myelogenous Leukemia, AML)、非霍奇金氏淋巴瘤(Non-Hodgkin Lymphoma, NHL)、B細胞淋巴癌(B cell lymphoma)及卵巢癌。
三、基因修飾細胞治療以CAR-T為主力、TCR-T具應用潛力
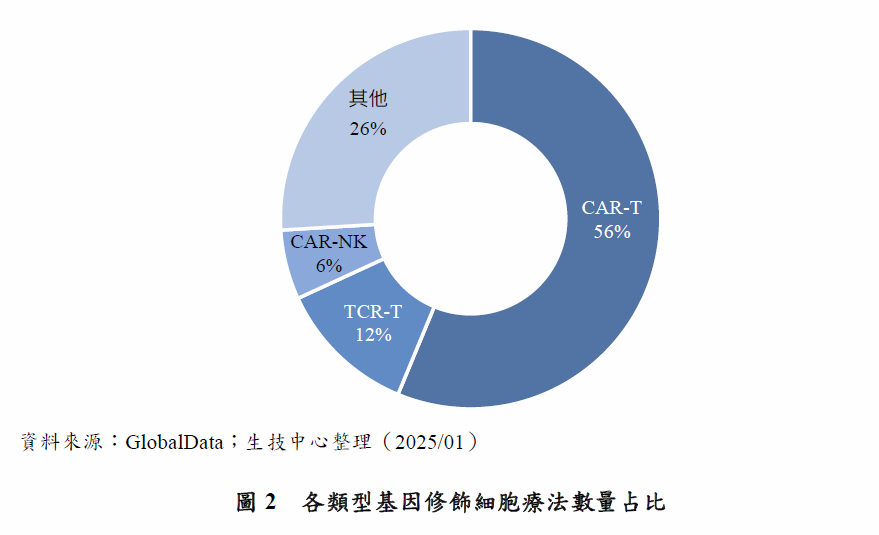
於GlobalData資料庫查詢基因修飾細胞療法,以CAR-T為最多數,占所有基因修飾細胞療法的56%,其次為TCR-T占12%、CAR-NK(嵌合抗原受體自然殺手細胞)占6%,其他則包括TCR-NK、CAR-M(嵌合抗原受體巨噬細胞)、HSC等,共占26%(圖2)。
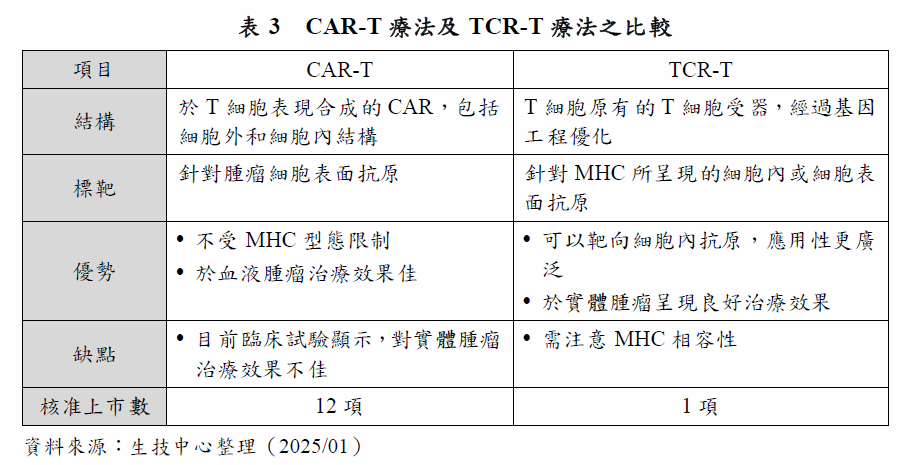
目前已核准的12項CAR-T療法適應症都是血液腫瘤,作用標靶分別為CD19(8項產品)和BCMA(4項產品)。觀察目前在開發中的CAR-T療法,CD19單一標靶或CD19合併其他標靶的CAR-T療法數量,約占所有開發中CAR-T療法數量的21%。標靶數量次多的是BCMA,單一或合併標靶的數量約為8%。而針對實體腫瘤的CAR-T療法標靶,如B7-H3、Claudin 18、Mesothelin等,進展最快的在臨床II期試驗階段,可見CAR-T療法於實體腫瘤的應用仍是目前極大的挑戰。
分析開發中的TCR-T療法,除了1項產品已核准上市,進展最快的在臨床II期試驗階段,但相較於CAR-T療法,標靶明顯更加多元。目前在臨床II期階段的TCR-T療法產品,作用標靶包括NY-ESO-1、KRAS、MART-1等,適應症均為實體腫瘤。
四、技術突破開創基因治療新領域
1. TCR-T開啟實體腫瘤治療新篇章
CAR-T療法是從病人體內抽取出T細胞後,利用基因工程讓這些T細胞表現特定的抗原受體,再將修飾過的T細胞擴增後注回病人體內,使其藉由CAR辨識表現特定腫瘤抗原的癌細胞,進一步毒殺癌細胞。
CAR-T療法的成功,始於2012年第一位接受CAR-T療法的小女孩Emily Whitehead,她於6歲時急性淋巴性白血病復發,化療無效後接受CAR-T療法,至今已連續11年體內沒有癌細胞。Emily Whitehead的治療成功讓各界驚豔,CAR-T療法成為劃時代的突破,2017年,美國FDA核准全球首2項CAR-T療法上市,至2024年已核准了12項CAR-T療法。然而,CAR-T療法常伴有嚴重副作用,例如大量細胞因子釋放造成的細胞激素風暴(cytokine storm)、CAR-T細胞攻擊正常細胞引發的脫靶效應(off-target effect)等,此外,CAR-T療法可能會產生繼發性T細胞腫瘤,因此FDA在2024年1月對6款FDA核准上市的CAR-T療法(Kymriah、Yescarta、Tecartus、Breyanzi、Abecma、Carvykti)發出黑框警告(Black Box Warning),警示CAR-T療法誘發二次血癌的風險,並且建議接受治療的患者必需終生監測。
2024年8月,美國FDA核准Adaptimmune Therapeutics公司的Tecelra上市,是全球第一款TCR-T療法,用於治療晚期滑膜肉瘤(Synovial sarcoma)這種罕見的實體腫瘤。Tecelra是第一個治療實體腫瘤的基因修飾T細胞療法,也是首個針對滑膜肉瘤的治療選擇。TCR-T療法是收集患者的T細胞,改良TCR以增強其辨識特定抗原的能力。TCR-T利用TCR來辨識第一類主組織相容性複合物(Major Histocompatibility Complex class I, MHC I)所呈現的腫瘤抗原,這些腫瘤抗原通常不直接表現在腫瘤細胞表面,但會在分解後和MHC分子一同呈現在細胞表面並被TCR辨認。TCR-T和CAR-T的原理類似,都是強化T細胞對腫瘤細胞的免疫毒殺能力,最大的差異主要在於TCR是T細胞原本即具備的分子,可以辨識在細胞內部經分解再呈現出來的腫瘤抗原,具有比CAR-T更廣的辨識能力,亦克服了CAR-T於實體腫瘤的限制(表3)。
2. 基因編輯療法帶給遺傳性罕病治療突破性進展
透過基因傳送機制的基因治療,是將正常的基因送至病人體內,以「外加」的方式提供具有正常生理功能的基因。而基因編輯療法最大的不同,在於基因編輯是透過基因或核苷酸的插入、刪除,來「修復」異常的基因序列。
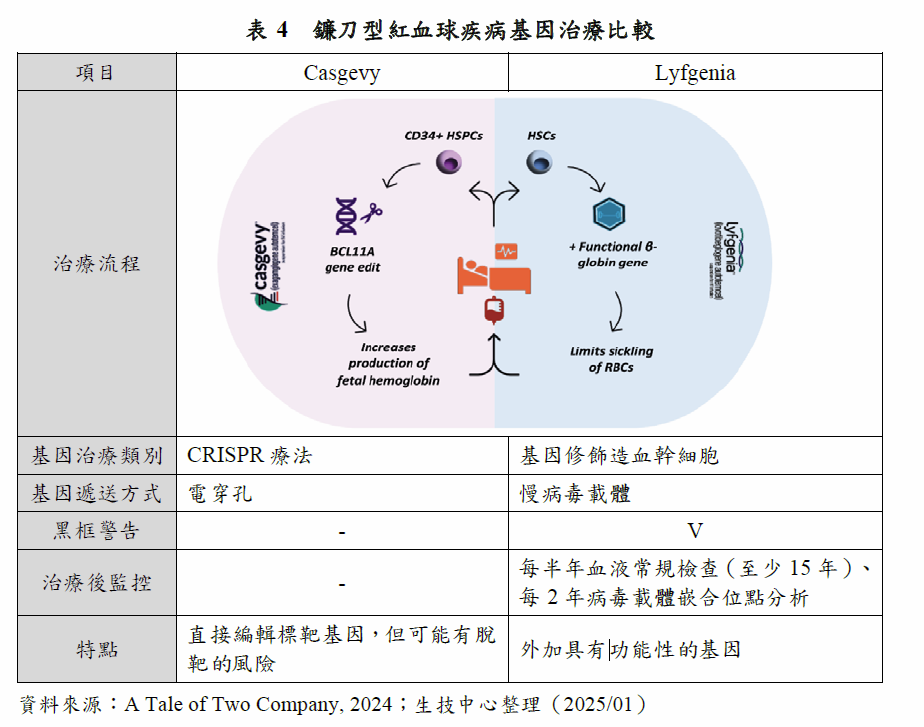
1990年代CRISPR機制在大腸桿菌(E. coli)被發現,2013年被應用於哺乳細胞基因的編輯,歷經10年的開發,第一款CRISPR療法終於上市。2023年12月,Vertex和CRISPR Therapeutics合作開發的Casgevy,獲FDA核准治療SCD和輸血依賴性β地中海型貧血(Transfusion-dependent β-thalassemia, TDT),為首項獲准上市的基因編輯療法,使用CRISPR/ Cas9基因編輯技術。
鎌刀型貧血為嚴重的遺傳性血液疾病,因為基因突變造成血紅蛋白(hemoglobin, Hb,即血紅素)異常,使紅血球形成鐮刀狀,導致貧血並且有血管阻塞危機(Vaso-Occlusive Crisis, VOC)。正常情況下,BCL11A基因在出生後即會啟動,抑制胎兒血紅蛋白(Fetal hemoglobin, HbF)製造,轉而以成人血紅蛋白為主;Casgevy療法便是透過修改BCL11A基因,關閉其抑制胎兒血紅蛋白的功能,重啟胎兒血紅蛋白以替代異常的血紅蛋白。Casgevy利用CRISPR/ Cas9基因編輯技術,CRISPR做為嚮導RNA(guide RNA, gRNA)可辨識特定(需修改)的DNA序列,Cas9則為DNA剪切酶,當gRNA辨識特定DNA序列後,Cas9會將其剪斷,再重新合成正常的DNA序列。
而在Casgevy被核准的同一天,FDA也核准了Bluebird Bio公司開發的Lyfgenia,兩者同為治療SCD的基因療法。Lyfgenia是自病人收集造血幹細胞,利用病毒載體將功能正常的β球蛋白基因遞送至造血幹細胞,再將修飾過的造血幹細胞輸回病人體內。
Casgevy和Lyfgenia都屬於ex vivo基因治療,但兩者的作用機制不同(表4)。Casgevy是利用CRISPR/ Cas9編輯造血幹細胞的BCL11A基因,降低BCL11A蛋白質表現讓胎兒血紅蛋白恢復產生;Lyfgenia則是利用LV載體,在造血幹細胞外加具有功能的β球蛋白基因,增加β球蛋白的製造。此外,Lyfgenia在臨床試驗時因為有受試者死亡,因此Lyfgenia加有黑框警告,且病人治療後需長期監控。
五、基因治療之挑戰
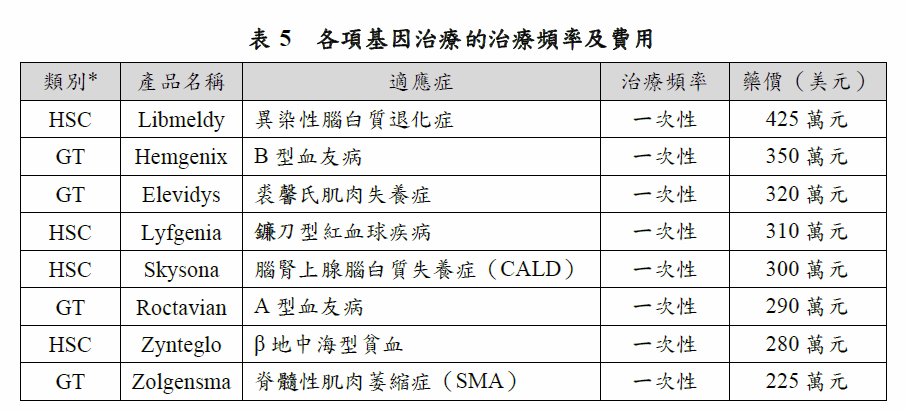
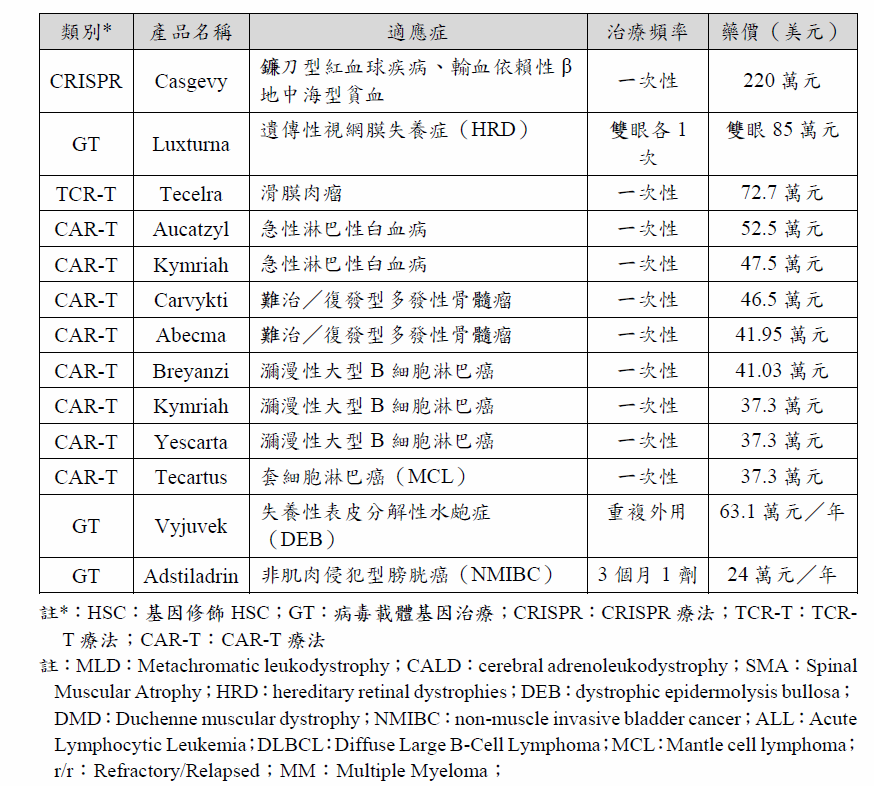
基因治療從研發、臨床前開發,到臨床使用,仍依循一般藥物的開發流程,但開發過程卻更為複雜。基因治療不同於小分子或抗體藥物等藥品,組成通常包括細胞、病毒載體、基因/質體(plasmid)等,造成基因治療不論是研發、生產製造或臨床應用,都有其複雜性,因此基因治療的費用動輒數十萬至數百萬美元(表5)。
藥物開發的技術大幅進步,新的技術也不斷發展,例如扮演關鍵角色的基因編輯技術、病毒載體等,使基因治療日趨多元,新型態基因治療從研發到上市的時間也越來越短,例如2023年上市的Elevidys,從第一次人體試驗到上市只花了5年的時間。而基因治療開發廠商一旦具有建置完成的技術平台及開發經驗,可以讓產品更快速上市。生產製造的複雜性是基因治療的挑戰之一,除了必需兼顧細胞以及病毒載體之外,還有其他組成如質體、蛋白質等。此外,基因治療大多是個人化醫療,在生產規範、產能之外,又增加地域性(在地化生產)的限制。重資本、高技術門檻,以及客製化生產步驟,讓許多藥廠以自建廠房(in house)以及尋求委託生產服務機構(Contract Manufacturing Organization, CMO)或委託開發暨生產服務機構(Contract Development and Manufacturing Organization, CDMO)的生產策略,來克服生產製造的挑戰。
相對於成熟的小分子或抗體藥物,基因治療仍在起步階段,僅管帶給許多以往認為無藥可醫的疾病治癒的希望,但基因治療的安全性以及療效持久性仍待長期觀察。克服基因治療開發各階段的挑戰,擴大應用性,並且降低醫療費用,將是基因治療蓬勃發展的最大目標。
12024醫藥產業年鑑,生技中心出版
2DMD為好發於男性的罕見性聯遺傳疾病,因編碼肌失養蛋白的基因發生突變,導致其失去功能無法如正常情況時保護肌肉免受損傷。DMD患者會出現肌肉萎縮、發育遲緩等症狀,甚至失去自主呼吸能力,並於30歲左右因心肺併發症而死亡。
3Gene, Cell, + RNA Therapy Landscape Report, American Society of Gene & Cell Therapy and Citeline, 2024
ITIS 智網 http://www.itis.org.tw
經濟部產業技術司科專計畫成果,未經同意不得轉載