
DCB產資組ITIS研究團隊
黃佩宇
2025年6月
隨著全球細胞與基因療法(Cell and Gene Therapy, CGT)的發展日趨成熟,CGT應用於癌症治療、遺傳性疾病與罕見疾病都有相當的成效,越來越多CGT產品獲得監管部門批准,CGT產品的臨床應用持續增長。CGT的發展不僅聚焦於前端的研發與臨床試驗、探索新穎療法與新興治療機轉,讓CGT從研發階段走向商業化,生產製造更為重要的推動關鍵,穩定的產品品質有助於實現療法的商業化。CGT產品製造涉及高度複雜的流程,無論是細胞擴增、病毒載體製造和基因編輯技術,技術門檻與製造成本高,還需符合法規與品管規範,對於開發CGT的生技醫藥公司而言自行製造的難度高且所費不貲,財務壓力負擔大。委託研究開發暨生產服務(Contract Development and Manufacturing Organization, CDMO)可提供完整從開發至製造的服務,減少CGT開發公司的建置成本與營運費用,並以其專業知識解決製造的挑戰。生技醫藥公司透過與CDMO公司合作,將CGT製造外包給CDMO公司,以降低內部整體成本與協力加速療法的開發。
一、新興細胞與基因療法的發展,推動製造服務產業持續前進
由於全球慢性病盛行率上升與遺傳性疾病的治療需求與日俱增,CGT具有解決未滿足醫療需求,治療以往無法治療疾病的潛力,加上各國政府積極推動開發新興的CGT,急速增長的CGT治療需求,推動全球CGT的製造服務市場成長。依據360iResearch資料,全球CGT製造服務市場規模由2023年的173.4億美元,推估2028年成長至358.7億美元,2023~2028年複合年成長率(Compound Annual Growth Rate, CAGR)為15.6%(圖1)。
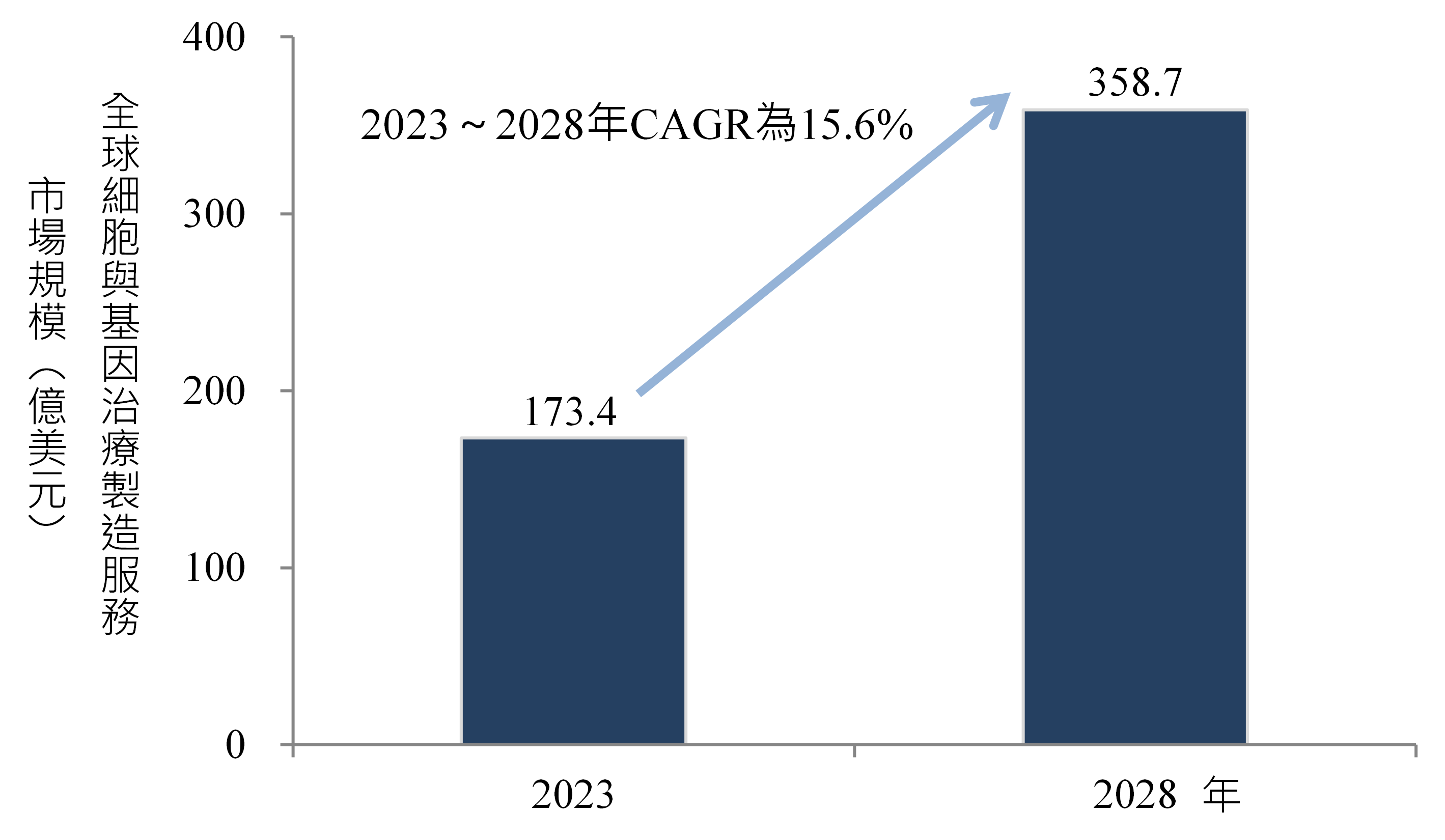
資料來源:360iResearch;DCB產資組ITIS研究團隊(2025/06)
圖1 2023年及2028年全球細胞與基因治療製造服務市場規模
全球CGT製造服務項目,可細分為優良製造規範(Good Manufacturing Practice, GMP)製造服務、分析與品管服務、載體製造服務、製程開發服務、充填服務、法規支援服務等。2023年全球CGT製造服務市場以GMP製造服務占比最高,約19.7%,製造合規的產品為最大的市場需求;其次為測試分析與品管服務,占比11.8%,提供專業的分析與品管服務以確保產品的安全性、有效性與穩定性:再其次為載體製造服務,占比11.5%,載體為基因治療的核心材料,為將目標基因送入細胞的重要攜帶工具,可以病毒載體或非病毒載體進行基因轉移(圖2)。
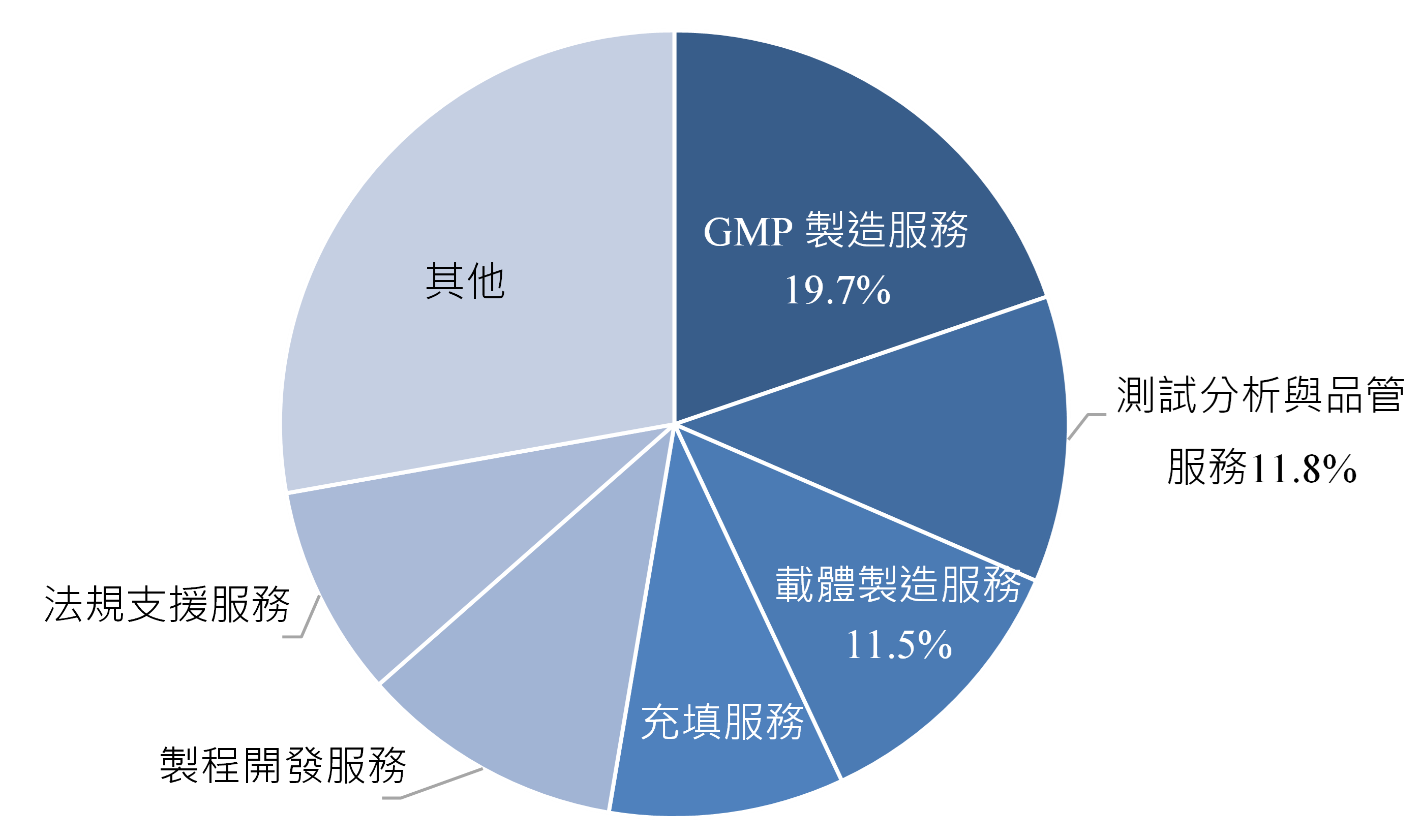
資料來源:360i Research;DCB產資組ITIS研究團隊(2025/06)
圖2 2023年全球CGT製造服務市場占比-依服務類型分類
提供製造服務的CDMO產業,擁有深厚的專業知識、製造基礎設施和流程開發能力。生技製藥公司與CDMO合作,如將製造外包給CDMO公司,可以優化製造的流程、提高製造量能、降低整體製造成本、解決製造的挑戰且確保產品在複雜監管環境下的合規性。相較於大藥廠或生技公司,小規模的生技醫藥公司更為缺乏內部部屬製程的能力,有越來越多的CGT開發公司採用外包策略,尋求與CDMO公司合作,有利於新興產品持續優化與靈活調整應對市場需求,以及有效分配公司資源。
二、美國引領全球新興細胞與基因療法的研發與製造
根據再生醫療聯盟(Alliance for Regenerative Medicine)發布的資料,全球投入CGT產品的開發公司快速成長,2024年全球CGT產品開發公司家數已逼近3,000家,主要分布於北美地區,占42.3%,其次為亞太地區及歐洲地區,占比分別為34.8%與19.7%(圖3)。2024年進行中的全球CGT臨床試驗數近2,000件,亦以北美的占比為最大,占42.8%,其次為亞太地區及歐洲地區,占比分別為37.5%與15.7%(圖4)。
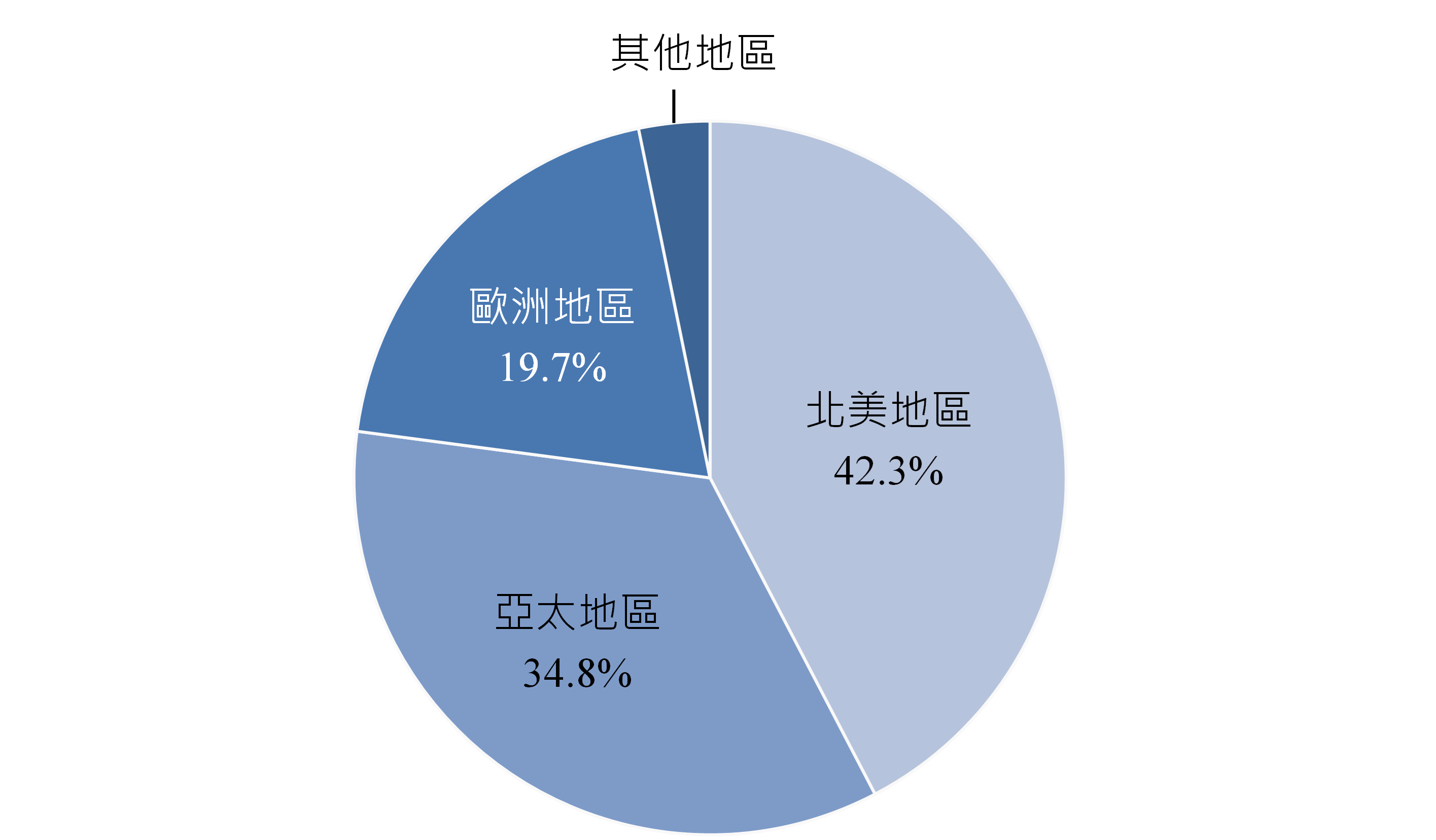
資料來源:Alliance for Regenerative Medicine;DCB產資組ITIS研究團隊(2025/06)
圖3 2024年全球CGT產品開發公司分布地區占比
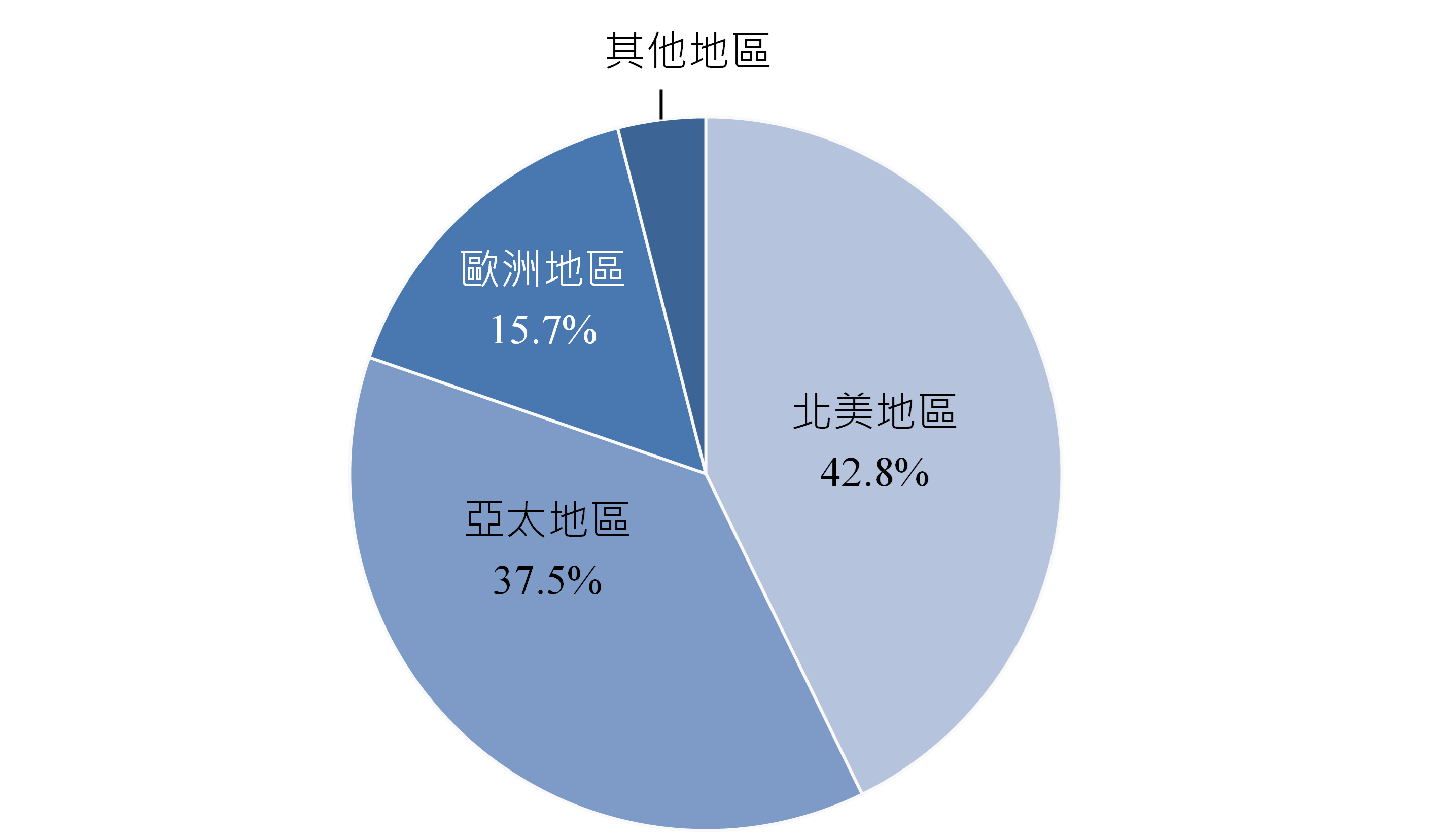
資料來源:Alliance for Regenerative Medicine;DCB產資組ITIS研究團隊(2025/06)
圖4 2024年全球CGT臨床試驗分布地區占比
歐洲藥品局(European Medicines Agency, EMA)定義先進治療藥品(Advanced Therapy Medicinal Products, ATMP)為三種主要類型,包含基因治療藥品(gene therapy medicines)、體細胞治療藥品(gene therapy medicines)與組織工程藥品(tissue-engineered medicines)。查爾斯河公司(Charles River Associates)公布的資料表示,2022年美國在先進醫療產品(Advanced Therapy Medicinal Products, ATMP)處於領先地位,全球超過半數的ATMP設施集中於美國。依據Grand View Research資料,2023年美國ATMP的CDMO市場約23.4億美元,占全球ATMP的最大份額,占比超過40%。
美國因在法規、資金與新興CGT技術方面具有優勢,醫療市場成熟,以及美國食品暨藥物管理局(Food and Drug Administration, FDA)的快速通道審批機制可加速審查程序,促進美國的CGT產品開發與臨床試驗開展,外加廠商考量製造地鄰近病患的產品最終交付地等因素,吸引廠商在美國設立製造基地,在CGT的研發與製造均占據領先的地位。美國的ATMP CDMO產業蓬勃發展,2024~2030年CAGR為18.3%。美國擁有新興療法製造能力,不僅掌握CGT產業的主導權,也大幅增加國內患者取得最新實驗性藥品與療法的機會,並減少新興CGT藥品的供應鏈風險。
三、CGT產業發展期盼不因製造監管而受限
當CGT產品進入市場時,其顛覆傳統藥品的獨特性,使得製造與監管成為影響產業發展的關鍵因素,而產業的進一步推動更有賴開發公司、製造商和政府監管部門合作,建立共識,共同將產品引導至安全有效的方向。政府監管部門增修訂相關指引,讓法規能與時俱進,提供廠商開發、製造、品管等方面依循準則,同時期盼不因法規而影響新技術之發展。另外,部分地區的監管部門也致力於簡化、加速審批流程,降低新參與者的進入門檻,增加產業的競爭,以及鼓勵開發公司不斷創新與優化產品。
製造法規方面,歐盟執委會於2017年通過《針對ATMP的GMP指引(Guidelines on Good Manufacturing Practice for Advanced Therapy Medicinal Products)》,於2018年開始實施,其中提及ATMP的GMP適用要求需有一定程度的靈活性,應用基於風險的管理方法,使ATMP製造商能夠根據製造流程和產品的具體特徵,規劃及實施最合適的產品製造流程以確保產品品質,這對於研究性臨床試驗階段的ATMP格為重要,符合產品開發持續發展的特性。此外,亦在指引中強調無意對新概念及新技術的發展施加限制,若廠商使用的替代方法可以滿足相同目標,則可在符合確保產品品質、安全性、有效性和可追溯性的情況下實施替代方法。例如細胞懸浮液非透明溶液,依其產品特性,可用外觀顏色測試搭配其他控制措施,取代計數顆粒物及大小的微粒測試方法。由於ATMP為複雜的創新產品,因其製造方面的限制以及產品效期短暫,為臨床試驗帶來物流管理的挑戰。歐盟執委會於2019年10月發布《ATMP的優良臨床試驗規範(Good Clinical Practice, GCP)指引(Guidelines on GCP specific for Advanced Therapy Medicinal Products)》,明確相關臨床試驗的合規性。ATMP的相關指引,在考量CGT特性下,幫助CGT藥品開發及製造商理解與滿足品質相關監管要求,降低廠商負擔,並期盼加速CGT產業在歐洲的發展。
美國於FDA 2016年12月通過《21世紀醫療法案(21st Century Cures Act)》,再生醫學療法如細胞療法、治療性組織工程產品、人體細胞和組織產品、基因療法等,符合治療嚴重疾病以及初步臨床證據顯示有解決未滿足醫療需求之潛力,有機會取得再生醫療先進療法(Regenerative Medicine Advanced Therapy, RMAT)資格認定,此認定包含快速審查(fast track)與突破性藥物(breakthrough)的優勢,可加速審查流程。因應CGT產品發展,美國FDA對於CGT的製造與品質監管,近年也提出若干指引,供廠商參酌並明確品質與製造規範。例如由於CGT產品的複雜性,製造變更對產品品質的影響面臨諸多考量與挑戰,美國FDA於2023年7月發布《人類細胞和基因治療產品的製程變更和可比性(Manufacturing Changes and Comparability for Human Cellular and Gene Therapy Products)》指引草案,為CGT產品的製造變更的管理,以及評估製造品質的可比性提供建議。此外,CGT產品的效價評估和確保產品效價一致性困難且複雜,美國FDA 2023年12月發布《細胞和基因治療產品效價保證指引草案(Potency Assurance for Cellular and Gene Therapy Products Draft Guidance for Industry)》,提供基於科學與風險基礎的CGT產品效價建議,以製程設計與控制、材料控制、製程中測試等方式,使每一批產品都能有達到預期的治療能力。在製造材料方面,美國FDA在2024年也發布《在細胞和基因治療以及組織工程醫療產品的製造中使用人類和動物性材料的考慮因素(Considerations for the Use of Human-and Animal-Derived Materials in the Manufacture of Cell and Gene Therapy and Tissue-Engineered Medical Products)》,提供關於CGT製造材料的安全性、品質和特性等建議。
四、細胞與基因治療的開發與製造相互協力_以CRISPR為例
CDMO公司協助開發公司導入新技術或提供技術平台,供產品前期開發與優化,將產品由設計開發轉為具體實現,並避免後期的製造與放大製程問題。以新興的CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)基因編輯療法為例,CDMO公司以其專業知識和合規的設施,協助開展CRISPR技術運用,包括搭配降低錯誤率的新型Cas9酵素;推出CRISPR傳輸的創新技術,例如縮小將CRISPR傳輸至目標細胞的質體尺寸;開發線相關病毒載體(Adeno-associated Viral Vectors, AAV)以外的替代方案,以提高針對特定組織的轉導效率,並且支持CRISPR技術的製造與落地應用。
CDMO公司建立CRISPR製造與技術服務,協助廠商持續優化技術與療法,並且加速產品上市。第一個美國上市的CRISPR基因編輯產品Casgevy,既是生技醫藥公司Vertex與英國專精CGT的CDMO公司RoslinCT合作,由RoslinCT在細胞療法長久累積的製造能力與經驗,與專為CGT產品製造設計之愛丁堡和美國波士頓的製造設施,提供最新穎的CRISPR產品。另一家美國CDMO公司Charles River接連在2016年與Broad Institute達成CRISPR/Cas9許可協議、2017年取得ERS Genomics專利授權,擴大可提供的CRISPR/Cas9服務範圍,提供客製化的in vivo和in vitro基因編輯服務。此外,Charles River亦與Vertex合作製造Casgevy,其位於美國田納西州的曼菲斯工廠通過美國FDA和歐洲藥品管理局(European Medicines Agency, EMA)的審查,可商業化製造Casgevy,助力Casgevy產品上市。
五、細胞與基因治療面臨製造成本高、品管不易與產品可及性受限等挑戰
產品的製造與交付影響CGT產業的發展。CGT產品需專門的製造設施,初期建置專業設施、設備和後續維護的成本費用高昂,加上複雜製程需要高技術人才,亦需要高成本營運費用,使得CGT的進入門檻相對較高,對於小型或是新的公司的而言受限於經濟實力不易進入,窒礙了CGT製造的競爭與技術創新。
CGT的生產製造與治療的安全與功效密切相關,由於其製程高度複雜,產品之穩定性與品質管控的難度高、極具挑戰,CGT製造過程應需要嚴格的規範。現今許多的CGT製程仍為依賴人員在平面的培養系統中手動操作進行,仰賴操作者的經驗與知識判斷,無法大規模的製造細胞,並容易面臨產品品質不穩定與污染等挑戰。此外,最終的CGT產品因具有活體的特性,一般常用的滅菌方式如加熱、輻射等都會造成產品失效而無法使用。
產品的交付時程與成本,受病患所在區域的設施建置情況影響,長途的物流運送,不僅增加產品變質與汙染的風險,還會增加治療費用與降低治療效率。CGT產品通常需量身訂做,難以降低單位製造成本,導致整體醫療費用昂貴,治療價格也限制了療法施用。以臺灣2021年批准的CAR-T細胞療法Kymriah為例,收集患者淋巴球後,需要空運送至瑞士的實驗室,待客製化的基因修飾CAR-T細胞完成且經品管確認後,再空運回台,因產品處理製造位置距離患者遙遠,運送過程需小心謹慎且耗費成本龐大。客製化的Kymriah療法價格高昂,健保給付價約達820萬元,病患若要自費治療負擔沉重。
六、結論
CGT的快速發展創造許多新的治療契機,而其顛覆傳統藥品的獨特性與製造的高度複雜性,使得製造與監管成為影響產業發展的關鍵因素。CGT產品需專門的製造設施,製造難度高,且需滿足品質一致性、安全性與合規性要求,導致製造設施建置成本與營運費用高昂,對於開發CGT的生技醫藥公司而言財務壓力負擔大。CGT產品製造的進入門檻困難,推升了CDMO產業在CGT製造領域的重要性,CDMO公司具專業技術與豐富經驗,可合規的製造CGT產品,成為CGT產業突破瓶頸的關鍵夥伴。透過與CDMO合作,開發公司能有效降低製造成本、解決製造挑戰與加速療法開發,並且有利於新興產品持續優化與在市場尚未成熟時,靈活調整應對市場需求。
以CRISPR為例,開發公司與CDMO公司協力合作,不僅促進技術進步,更使產品之可實際落地應用,推動產品上市。因應CGT產品快速發展的挑戰,政府監管部門也與時俱進增修法規指引,簡化審批流程,降低新進入之門檻,並鼓勵產品的創新與優化。因應CGT的製造挑戰,CDMO公司推動製造技術創新與精進設備,如透過標準化製造模組、自動化製造系統與資料分析方面的進步,提高製造效率、精確度和穩定性,並與開發公司持續合作,以優良的製造能力與品質推動CGT產業發展。