
DCB產資組ITIS研究團隊
劉曉君
2023年4月
數位科技擴大了臨床試驗相關數據蒐集的途徑,也為臨床試驗進行方式帶來變革轉機,雖然運用數位科技進行遠端醫療及數據收集的分散式臨床試驗(Decentralized Clinical Trial,DCT,又稱去中心化臨床試驗)已行之有年,但DCT的使用在COVID-19(Coronavirus Disease 2019)疫情發生之前並不普及,然隨著數位科技與工具不斷進步使得DCT的運作更加可行,又在COVID-19疫情造成臨床試驗不便之推波助瀾下,不但加速了生醫產業對DCT的採用,也加速了各國相關主管單位對DCT採用的接受度。在產業採用及法規支持下,DCT相關技術的應用漸增,此種以患者為中心的臨床試驗模式不但為受試者/患者或醫療人員帶來便利性,也為生醫產業節省臨床試驗成本和時間,甚至讓臨床試驗的執行更具彈性及有效性,因此,DCT越發成為臨床試驗的重要發展趨勢。
一、數位科技的進步使DCT成為臨床試驗的未來發展趨勢
在傳統的臨床試驗中,受試者必須到試驗現場接受臨床試驗篩選、徵得同意、在現場與臨床試驗執行人員進行頻繁互動等,Parexel International公司的一份調查顯示,70%的潛在受試者居住在距離試驗地點需車程2小時以上的地方,因此降低了臨床試驗收案人數及群體的機率及可能性;然DCT的採用不但能解決前述耗時的問題,更有助覆蓋更多、可能更多樣化的受試者群體,也讓臨床試驗的執行有更多選擇,使臨床試驗的設計和執行更具有靈活度,提升藥物開發的成功率並加速上市。
美國食品暨藥物管理局(Food and Drug Administration, FDA)對DCT的定義為透過遠端醫療和移動式/本地醫療保健提供者執行的試驗,使用不同於傳統臨床試驗模型的流程和技術。由於一系列包括DCT會應用到的遠端醫療、電子同意書、電子臨床結果評估(Electronic Clinical Outcome Assessment, eCOA)及電子化患者回饋結果ePRO(electronic Patient Reported Outcome, ePRO)等移動設備和穿戴式設備相關技術和服務不斷發展,使臨床試驗研究人員無需親自到研究地點訪問即可與臨床試驗受試者保持聯繫,行動裝置及替代站點使更多臨床程序能夠在遠離研究地點的地方持續進行(圖1),讓DCT的應用更加可行。
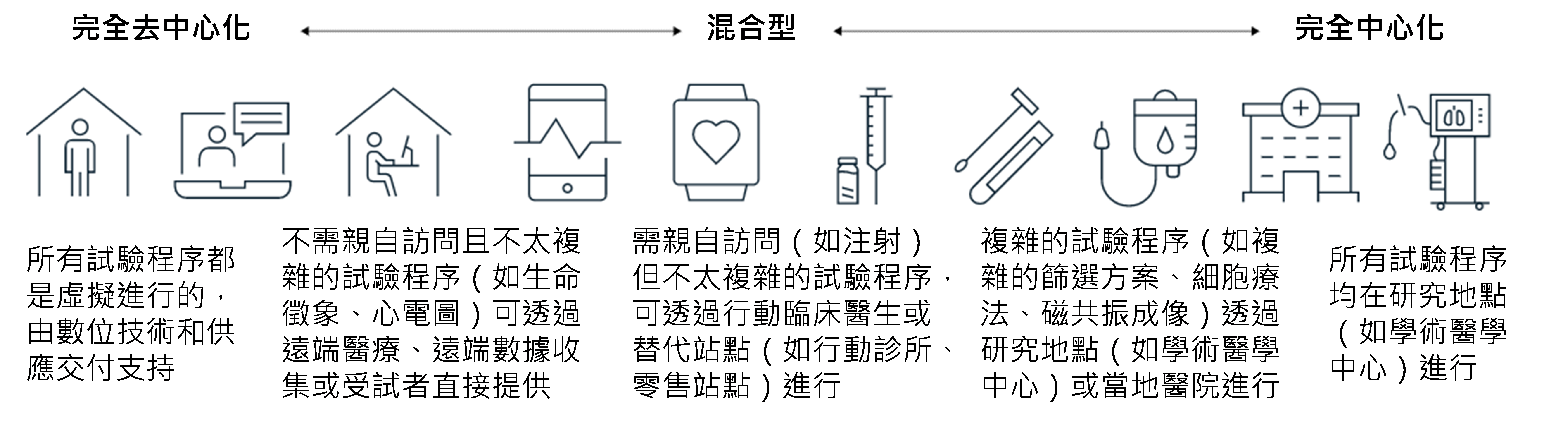
資料來源:McKinsey & Company;DCB產資組ITIS研究團隊(2023/01)
圖1 去中心化/中心化臨床試驗設計
二、採用DCT的臨床試驗數占比漸增,知名國際製藥大廠及CRO廠商為主要參與者
依據Frost & Sullivan調查,2020年之前,採用DCT的臨床試驗件數占全球臨床試驗件數的1~3%,然在2020年COVID-19疫情之後,採用DCT的臨床試驗件數占比倍增,因DCT的採用優勢及產業需求趨勢,預估2026年採用DCT的臨床試驗件數在全球臨床試驗件數占比將達13%。雖然部分生醫廠商並不願意透露執行的臨床試驗中是否採用DCT相關技術,但GlobalData子公司Clinical Trials Arena從GlobalData製藥情報中心的資料分析,以製藥及藥品委託研發服務(Contract Research Organization, CRO)廠商涉及遠端醫療、遠端監控、數位數據收集等元素的臨床試驗件數估算廠商在臨床試驗中採用DCT的占比進行分析。研究調查顯示,2022年採用DCT占比最高的製藥廠商為Takeda,採用DCT相關技術的臨床試驗件數占比高達1/3,其次為Bayer AG及Sanofi等公司(圖2),從調查結果觀察,採用DCT的前10大藥廠中6成為全球營收前10大藥廠,包括Pfizer、Novartis AG、Roche、Merck KGaA、AstraZeneca、Sanofi等公司,預期在國際大藥廠的引領下,對製藥產業未來採用DCT相關技術具有帶動的效果。
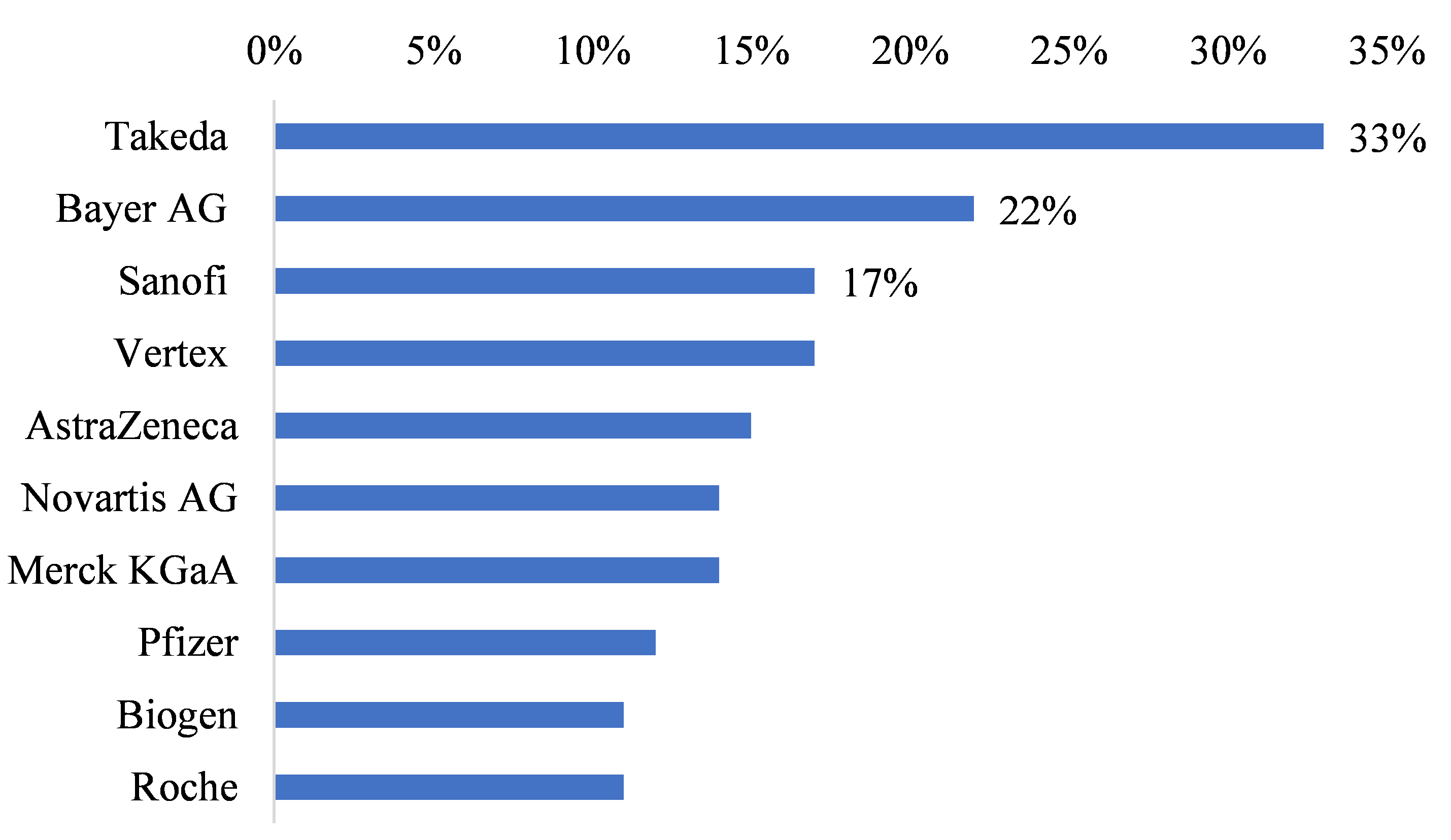
資料來源:GlobalData;DCB產資組ITIS研究團隊(2023/01)
圖2 2022年採用DCT占比高之前10大藥廠
2022年採用DCT占比最高的CRO廠商為Avance Clinical,採用DCT相關技術的臨床試驗件數占比將近一半,其次為CMAX Clinical Research及Quotient Sciences等公司(圖3),與製藥廠商不同的是,採用DCT的CRO廠商雖不乏PPD、IQVIA等國際大廠,但並非使用占比最高的廠商,研判研究中使用DCT占比較高的中型CRO廠商如Avance Clinical,可能將採用DCT視為利基優勢之一,藉以增加與國際大藥廠合作的機會。
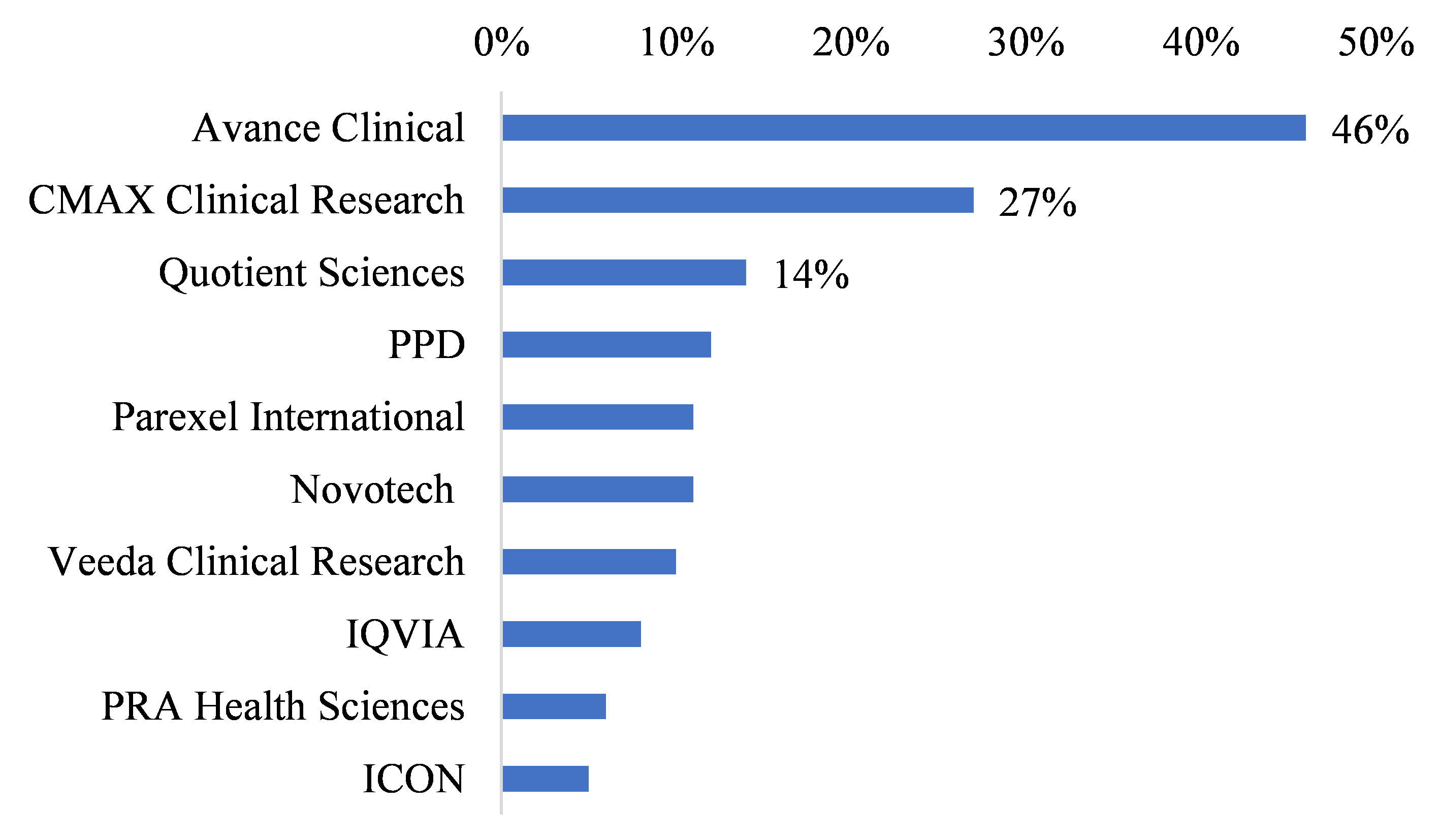
資料來源:GlobalData;DCB產資組ITIS研究團隊(2023/01)
圖3 2022年採用DCT占比高之前10大CRO廠商
三、歐美先進國家法規支持DCT相關技術在臨床試驗的採用,有助推進產業應用
COVID-19疫情阻礙了傳統臨床試驗的進行,但卻加速了DCT相關技術在臨床試驗的採用,美國FDA和歐洲藥物管理局(European Medicines Agency, EMA)相繼於2020年發布相關的臨床試驗指引:美國FDA 2020年3月公布《COVID-19期間臨床試驗緊急指引(Guidance on Conduct of Clinical Trials of Medical Products during COVID-19 Public Health Emergency)》,內容包括放寬電話訪談、虛擬訪視、遠距監控設備應用、遠距臨床結果評估等,在COVID-19期間改善及塑造未來臨床試驗的設計和管理;EMA在同期間陸續公布多個COVID-19期間臨床試驗管理指引,包括《申辦者如何在COVID-19大流行期間管理臨床試驗指引(Guidance to Sponsors on How to Manage Clinical Trials during the COVID-19 Pandemic)》及《COVID-19期間臨床試驗管理指引(Guidance on Managing Clinical Trials during Coronavirus (COVID-19))》等,內容涵蓋將現場訪視改為遠距訪視、放寬遠距查驗評估模式等建議,以及針對治療COVID-19的新臨床試驗對大型且跨國臨床試驗提出之具體建議等;從前述各項指引內容皆可看出,DCT相關技術的應用已被納入歐美臨床試驗法規中。
從美國FDA近年所發布的法規觀察,雖然美國FDA鼓勵採用DCT於臨床試驗,但目前並未針對DCT發布明確的指引文件,目前僅建議相關單位在採用DCT相關技術於臨床試驗時遵守其於2022年1月公布的《臨床研究中使用數位醫療科技執行遠端資料蒐集指引(Digital Health Technologies for Remote Data Acquisition in Clinical Investigations)》。但在EMA的法規進程方面,為了因應越來越多數位工具使用在臨床試驗,尤其在COVID-19疫情發生後,更凸顯數位工具和分散式技術在醫療環境和臨床試驗中的重要性和實用性,因此EMA於2022年12月發布《關於臨床試驗分散要素的建議文件(Recommendation Paper on Decentralised Elements in Clinical Trials)》,內容包括DCT中涵蓋的遠端監控和診斷、電子知情同意、家庭健康訪問和研究藥物直接運送給患者等要素的規定概述,目的除了促進DCT的實施,同時也保護參與者的權利和福祉以及所收集數據的穩定性和可靠性。由於DCT目的是要透過減少前往中央試驗地點的需要,使患者更容易參與臨床試驗,因此有助於吸引更多臨床試驗參與者並降低退出率,但前提應確保臨床試驗參與者的安全、權利和尊嚴得到必要的保護,並應保證發布和提交監管決策的數據的可靠性,因此EMA發布DCT指引,預期將有助促進在歐盟/歐洲經濟區的臨床試驗對DCT的採用。
四、小結
基於在臨床試驗中採用DCT對受試者所帶來好處,以及對臨床試驗執行及藥物開發進程所帶來的助益,DCT的應用不但更為可行,且也逐漸被廣為採用。對生醫廠商來說,在臨床研究中採用DCT可降低10~15%的臨床試驗成本,再加上採用DCT對於臨床試驗執行所帶來的種種好處,都加速了DCT的產業應用;科技大廠Oracle Life Sciences在2020年的調查顯示,76%的臨床試驗受訪單位未來將投資DCT的應用。雖然臨床試驗產業一直對DCT很感興趣,但直至COVID-19疫情發生後才加速推進了DCT的應用。從生醫廠商採用DCT的地點觀察,DCT的應用主要集中在歐美國家,此與歐美國家在數位技術及工具較為先進,以及COVID-19疫情較早爆發有關之外,也與這些國家已訂定相關法規因應,支持DCT相關技術應用有很大的關係。畢竟DCT的概念相對於傳統臨床試驗模式仍處於起步階段,雖然數位科技進步與COVID-19疫情影響下促進並加速生醫產業對DCT的應用,但在主管機關鼓勵DCT相關技術採用的同時,若能制定明確法規供業者遵循,必能有助於促進DCT的產業應用發展,讓DCT為患者、研究單位和生醫產業帶來了更高的價值。
相關連結